Увидеть больше: Нобелевскую премию по химии вручили за развитие криоэлектронной микроскопии
Нобелевскую премию по химии вручили за развитие криоэлектронной микроскопии
- © @NobelPrize
Нобелевская премия по химии за 2017 год присуждена швейцарцу Жаку Дюбоше, американцу Йоахиму Франку и британцу Ричарду Хендерсону — «за развитие криоэлектронной микроскопии высокого разрешения для определения структуры биомолекул в растворе». В заявлении Нобелевского комитета говорится, что развитие этой технологии одновременно упрощает и улучшает визуализацию биомолекул.
Председатель Нобелевского комитета Сара Сногеруп Линсе назвала работу учёных «революцией в биохимии».
Метод криоэлектронной микроскопии заключается в получении высококачественных изображений благодаря исследованию образца при сверхнизких температурах. Он позволяет наблюдать за объектами (от молекул белка до вирусов) фактически в естественной среде, без их фиксации или окрашивания.
BREAKING NEWS The 2017 #NobelPrize in Chemistry is awarded to Jacques Dubochet, Joachim Frank & Richard Henderson. pic.twitter.com/RUZSnArJHO
— The Nobel Prize (@NobelPrize) 4 октября 2017 г.
Долгие годы считалось, что электронные микроскопы пригодны исключительно для изучения и визуализации мёртвой материи, поскольку мощный поток электронов уничтожает биологический материал. Однако работы Дюбоше, Франка и Хендерсона позволили добиться очень быстрого замораживания биомолекул, позволяющего им сохранять свою естественную форму даже в вакууме, а также получить качественные изображения.
Изучаемый образец подвергается сверхбыстрой заморозке (витрифицируется), благодаря чему раствор, в котором находятся живые объекты, не кристаллизуется, а переходит в стекловидное состояние. Обычно витрификация биомолекул производится в этане, который поддерживается при температуре жидкого азота.
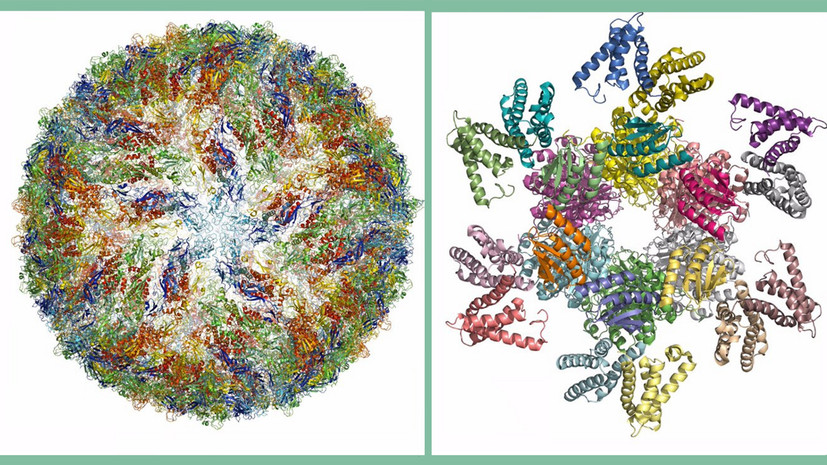
Желаемое разрешение в несколько ангстремов (10 в -10 степени метра) было достигнуто в 2013-м, и за последние годы были созданы 3D-изображения множества биологических объектов — от белков, вызывающих устойчивость к антибиотикам, до вируса Зика. С развитием криоэлектронной микроскопии биохимия переживает бурный рост, заявили в Нобелевском комитете.
Криоэлектронная микроскопия помогает учёным понять структуру и взаимодействие белков и других биомолекул. В перспективе это позволит, в частности, создавать более совершенные лекарства.
The final technical hurdle was overcome in 2013, when a new type of electron detector came into use. pic.twitter.com/Ue9c0R6v7y
— The Nobel Prize (@NobelPrize) 4 октября 2017 г.
Криоэлектронная микроскопия значительно отличается от метода рентгеновской кристаллографии, который требует кристаллизации образца и не лучшим образом подходит для изучения больших белковых комплексов. Из-за сложности получения монокристалла и вероятной непредсказуемости процесса традиционные методы не давали адекватных результатов в изучении больших молекулярных агрегатов.
Доктор химических наук, академик Российской академии естественных наук Вадим Мальцев рассказал RT, что криоэлектронная микроскопия стала серьёзным шагом вперёд на пути изучения строения молекул и молекулярных реакций. По его словам, это обусловлено тем, что в растворе биомолекулы ведут себя в значительной степени по-иному, «нежели в стопроцентном виде».
«Это важная отрасль электронной микроскопии с точки зрения познания свойств молекул, поведения молекулярных агрегатов в растворах, а когда речь идёт о биомолекулах — они работают и в растворах, и в коллоидных системах. И иметь возможность изучать, видеть в электронном микроскопе эти молекулы, молекулярные агрегаты — это серьёзный шаг вперёд», — подчеркнул эксперт.
Он добавил, что электронная микроскопия — это довольно интенсивно развивающееся научно-исследовательское направление. А криоэлектронная микроскопия стала очередным, но далеко не последним шагом в этом направлении, который даёт учёным очень важный инструмент познания и молекулярных реакций, и строения молекул, и молекулярных агрегатов.
Atomic structures of a) protein complex that governs circadian rhythm b) pressure sensor of the type that allows us to hear c) Zika virus pic.twitter.com/ixAyJesj99
— The Nobel Prize (@NobelPrize) 4 октября 2017 г.
Метод криоэлектронной микроскопии был в 2015 году удостоен престижной награды Method of the Year, ежегодно присуждаемой журналом Nature Methods способам анализа, которые внесли наибольший вклад в развитие науки. А в 2009 году Нобелевская премия по химии была вручена Тому Стайцу, Венкатраману Рамакришнану и Аде Йонат за определение структур рибосомы — именно с помощью криоэлектронной микроскопии.
Один из лауреатов Нобелевской премии 2017 года — Йоахим Франк — уже отреагировал на присуждение ему престижной награды.
Joachim Frank on receiving the phone call from Stockholm today. Interview coming soon! pic.twitter.com/dXcIErqX2X
— The Nobel Prize (@NobelPrize) 4 октября 2017 г.
«Обычно рано утром меня будет мой пёс, но сегодня это была Нобелевская премия», — сказал учёный.